概述
免疫细胞培养的六个基本流程:样本制备、细胞分选、分型鉴定、扩增&培养、质量优化、后续研究。小爱给大家详细分享了《免疫细胞培养攻略之样本制备(一)》,今天继续通关第二关:细胞分选。
细胞分选(Cell Sorting):根据细胞所具有的特性把某种特定的细胞亚群从混合的细胞样品中分离出来的一种技术,它是对某一特定细胞进行生化分析和功能分析的前提和基础。
在进行细胞分选前,我们要明确目的细胞占比、标记物、选择何种分选方法。
目的细胞占比:不仅涉及到样本的选择,也关乎我们是否进行样本的预富集,这部分内容我们在样本制备篇章已经给大家列举出来了。
免疫细胞标记物:人免疫细胞分型标记物图谱基本上涵盖了所有的免疫细胞及鉴定标记物,需要的小伙伴快快拿走!
表1 人免疫细胞分型标记物表
细胞类型 | 标志物 |
T细胞 | CD3、CD4、CD8 |
B细胞 | CD19、CD20 |
DC细胞 | CD11c、CD123 |
NK细胞 | CD56 |
造血干细胞 | CD34 |
巨噬细胞/单核细胞 | CD14、CD33 |
粒细胞 | CD66b |
目前细胞分选的常规方法分为四种:磁珠分选(Magnetic Cell Separation)、流式分选(Fluorescence-activated Cell Sorting)、免疫密度梯度细胞分选(Immunodensity Cell Isolation)、微流控细胞分选(Microfluidic Cell Sorting)。小爱在这里也给大家汇总了四种方法的原理以及优缺点。
表2 四种细胞分选方法的比较

由于磁珠分选和流式分选是现在细胞分选很常用的,接下来给大家详细介绍这两种方法的分选策略。
磁珠分选策略
磁珠分选的分选策略:阳性分选、阴性分选、多重分选、全血分选。
阳性分选:目的细胞被磁珠标记后,作为阳性组分直接分选出来。分选后的细胞不必去除MACS微珠,可立即用于培养或者后续操作。该方法可以将磁性标记的靶细胞富集10000倍。阳性分选的纯度更好,尤其是针对某些需要富集的稀有细胞,回收率也更高;

图1 磁珠分选中阳性分选示意图
阴性分选:磁性标记非目的细胞,将其从细胞混合物中去除,即为磁性标记的细胞为目的细胞,阴性分选也称为去除分选;
适用范围:去除不需要的细胞;缺乏针对目的细胞的特异性抗体(如肿瘤细胞);不需要抗体和目的细胞结合,即细胞不被激活(如T细胞、B细胞、NK细胞功能分析)。
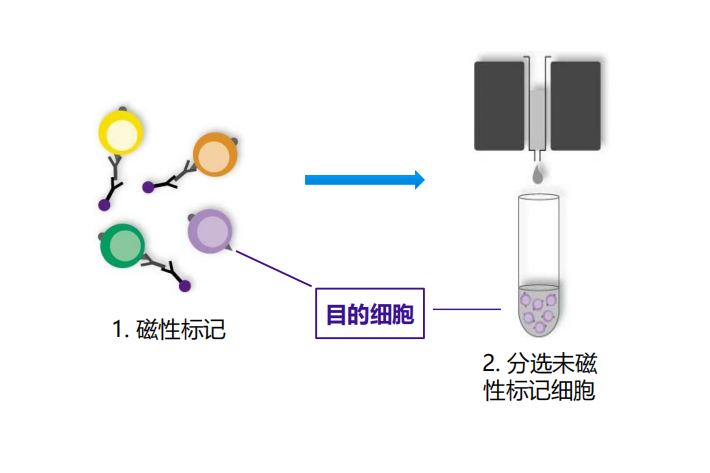
图2 磁珠分选中阴性分选示意图
多重分选:有两种方案:方案一:阴性分选+阳性分选,即先去除部分非目的细胞,再进行阳性分选;方案二:多选磁珠+阳/阴性分选,即先用多选磁珠阳性分选细胞,剪切去除磁珠后,再对分选的细胞进行二次分选;
适用范围:在细胞悬液中,非目的细胞也表达用来阳性选择目的细胞的抗原,就需要先去除这群非目的细胞,或者选择多选磁珠/REAlease磁珠,解离细胞表面的磁珠后,再对分选后的细胞进行二次分选;如果要分选非常稀有细胞,先从细胞悬液中去除非目的细胞,在富集细胞的基础上,进行阳性分选,可获得高纯度目的细胞。
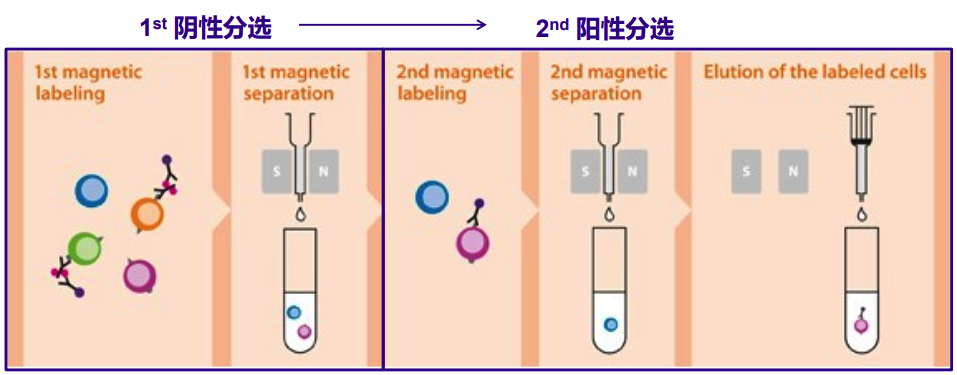
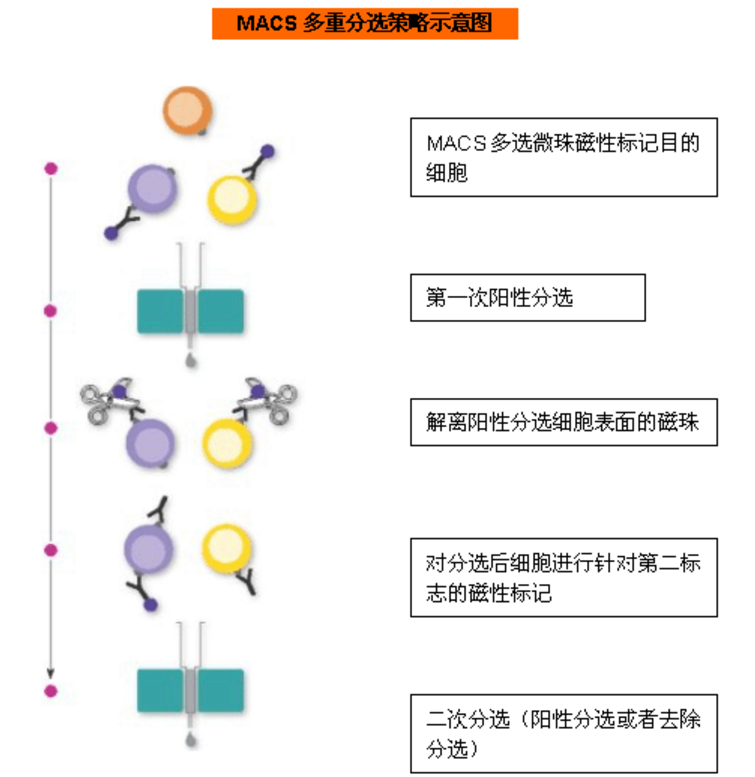
图3 磁珠分选中多重分选示意图(上:阴性分选+阳性分选;下:多选磁珠+阳/阴性分选)
全血分选:传统方法从外周血中分选细胞,需要先制备PBMC,再进行后续的磁珠分选或者流式分选,操作时间长达2h。美天旎含有一款全血磁珠,无需裂解红细胞,无需密度梯度离心,30min之内即可获得活性好、得率高的目的细胞。
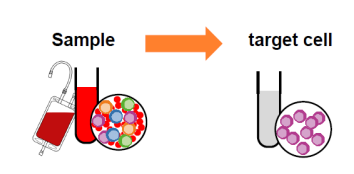
图4 磁珠分选中全血分选示意图
流式分选策略
流式分选策略:流式分选的步骤相对来说比较固定:
1、制备单细胞悬液;
2、细胞染色;
3、细胞分选;
4、后续细胞培养、分析。
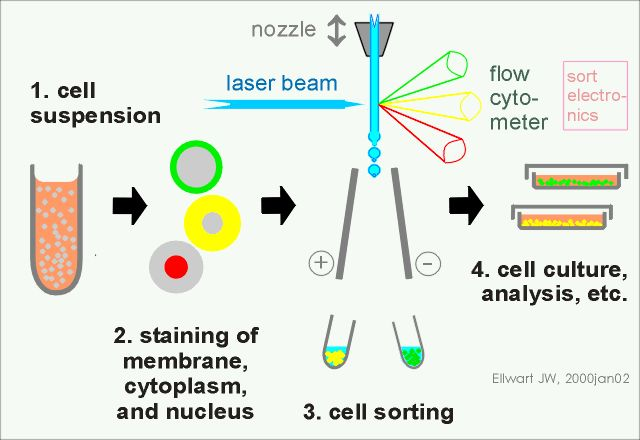
图5 流式分选的基本步骤
其中比较困难的就是关于抗体偶联荧光素的选择,很多老师会遇到这种情况,确定好了要分选的细胞的marker,但是偶联的荧光素不知道怎么选。一般来说需要遵循三个原则:
1、根据仪器配置选择荧光素:多色标记荧光素搭配时还应当每个通道只选择一种荧光素;各个通道之间的荧光素可以互相搭配;
2、根据抗原表达强弱合理分配荧光素:即抗原为高表达的话,可以将其与荧光强度较低的荧光素抗体相结合;
3、选择光谱重叠小的荧光素:由于荧光素的宽发射谱的特点,荧光通道间有光谱重叠现象,因此选择荧光素组合时要将光谱叠加可能性减到zui低。多色流式实验的时候往往需要通过补偿调节消除光谱重叠的影响。
这里给大家汇总一些流式分选的tips:
1、因为分选得到的细胞还要继续培养,所以务必保证样本的无菌状态;
2、不能使用固定剂固定细胞,因为活细胞经固定剂处理后即死亡;
3、细胞重悬液中加入PH调节剂HEPES(终浓度25mM,PH调节范围6.8-8.2),减少高压对PH的改变;
4、鞘液中避免含有抑菌剂,如乙醇胺类物质,以免影响细胞活性;
5、如细胞分选后需再次培养,需准备含血清的收集管;保证分选完毕时血清浓度大于5%;
6、如要去除死细胞,在不影响后续实验前提下,可加入7-AAD、PI或DAPI;
了解了两大常用的细胞分选方法后,我们应当如何选择呢?
流式分选可进行多参数分选以及不同荧光强度的分选,但对设备要求较高,对细胞刺激较大但分选灵活可以达到多方面的分选要求;磁珠分选操作简单,分选速度快,细胞活性好,对设备和技术员的要求较低,但只能根据一个参数进行分选,而且也不能针对细胞胞内标记物进行筛选。这里小优也给大家详细对比了流式分选和磁珠分选的优劣势:
表3 流式分选与磁珠分选的比较

一般来说,如果磁珠分选能达到研究要求,一般选择磁珠分选,若磁珠分选达不到要求则再考虑用流式进行分选。
以磁珠分选PBMCs样本中人Tregs细胞为例,帮助大家更好的get要点:
Tregs是CD4+ T细胞的一个亚群,它最特异性的标签是核内转录因子Foxp3,此外,它还高表达IL-2α受体(IL2Rα)—CD25,因此,经典的Treg标志是CD4+ CD25+ Foxp3+ T。如果我们检测Tregs细胞,可以选择膜标记及核标记同时鉴定,但如果我们需要分选Tregs细胞并进行后续的培养,那就无法借助核转录因子Foxp3了,因为磁珠分选只能进行膜蛋白的标记,流式分选标记Foxp3时,需要固定、透化步骤,会导致细胞死亡。所以分选Tregs细胞选择的标记物一般为:表面蛋白CD4、CD25。
其分选策略为先阴性分选,再阳性分选。
1、首先使用biotin偶联的混合抗体(CD8、CD14、CD15、CD16、CD19、CD36、CD56、CD123、TCRγ/δ、和CD235a)标记所有CD4-细胞,再加入Anti-Biotin MicroBeads,那么先经过磁场流出的是CD4+细胞;
2、在预富集的CD4+细胞中再加入CD25磁珠进行阳性标记,待流出未标记组分后,再进行洗脱,即可获得高纯度的CD4+CD25+调节性T细胞。
今天讲解就到这了,下一期我们讲解分型鉴定,大家如有细胞培养问题,欢迎后台交流哦!
本期小爱推荐
货号 | 品名 | 规格 |
abs930 | 人淋巴细胞分离液 | 200mL |
abs9772 | 免疫细胞无血清培养基 | 1L |
abs160019 | Anti-Human CD3/CD28 Monoclonal Antibody Beads | 1mL |
abs7995 | Anti-FITC Micro Beads | 2mL |
abs7984 | 24孔磁标板 | 1个 |
abs7985 | 96孔磁标板 | 1个 |
abs7997 | 分选柱套装 | 1kit |
abs7054 | 25mL一次性血清移液管 | 200支/箱 |
abs7033 | 细胞培养板(标准透明6孔板) | 50个/箱 |
abs7011 | 25cm²细胞培养瓶(50mL,透气盖) | 200个/箱 |
Absin产品线:
爆款产品:试剂盒(mIHC、IHC、凋亡、ELISA、ChIP、Co-IP、TR-FRET、生化检测、残留检测、多因子检测);细胞培养(类器官试剂盒+基质胶,胎牛血清+培养添加剂+细胞因子)、分化试剂盒;分子(mRNA合成服务+提取试剂盒);化合物大包装;辅助试剂、耗材/仪器、定制服务(抗体/多肽/蛋白/标记/检测)...
特色产品:鸡胚提取物CEE、B27、N2、霍乱毒素B亚单位CTB、牛脑垂体提取物BPE、百日咳毒素PTX、重组人胰岛素Insulin、人源低密度脂蛋白LDL...
电话
微信扫一扫
