生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制备,用于预防、治疗和诊断人类疾病的制剂。当前,随着越来越多的生物制品进入治疗领域,于是生物制品与之俱来的生物安全性问题被渐渐提上日程,生物制品的质量控制也日趋严格。其中宿主细胞残留核酸由于可能会传递肿瘤或病毒相关基因,存在潜在致癌性和感染性风险。各国药品监督管理机构对生物制品中宿主细胞残留核酸的态度谨慎且明确,要求各制药企业建立详细可行、灵敏度高的检测方法,用于验证药品的纯化过程可以去除残留DNA,并对终产品的放行严格把关,避免携带外源DNA的药品流入市场。
宿主细胞残留DNA标准
各国药品监督管理机构均对生物制品中宿主细胞DNA的残留量进行了严格的限度控制以规避风险。
表1 宿主细胞残留DNA标准
药典 | 标准 |
中国药典2020版 | 以细胞基质生产的生物制剂DNA残留量不能超过100pg/剂; 以细菌或真菌基质生产的疫苗,其宿主DNA残留量应≤10ng/剂。 |
WHO | 推荐非肠道接种成品中残留DNA不高于10ng/剂; 口服类成品中残留DNA不高于100ug/剂。 |
FDA | 生物制品宿主细胞DNA残余限度为100pg/剂; 对于大剂量生物制品如单克隆抗体,根据其残留DNA来源及给药途径不同,DNA残留量可放宽至10ng/剂; 对于选用连续非致瘤性细胞生产的生物制品成品,其DNA残留量应控制在10ng/剂以下,长度不大于200bp。 |
欧洲药典 | 规定生物制品残留DNA限度不超过10ng/剂。 |
除了对宿主核酸残留量有限度规定,我国对于DNA残留片段的大小也有了明文规定:2022年,我国国家药品监督管理局药品审评中心发布的《体内基因治疗产品药学研究与评价技术指导原则(试行)》中提到对于生产若使用了肿瘤细胞系致瘤细胞系或携带有致瘤基因、病毒来源序列的细胞(如HEK 293T细胞),在确保无完整活细胞残留的同时,需对DNA的残留量和残留片段大小进行控制。建议尽量将残留DNA控制在10ng/剂以内,DNA残留片段的大小控制在200bp以下。

表2 宿主细胞残留DNA片段风险因子
宿主细胞残留DNA片段大小(bp) | 风险因子 |
<200 | 1 |
200-1000 | 2 |
>1000 | 3 |
>1000 | 4 |
注:片段越长,风险因子越大。
宿主细胞残留DNA检测方法
为确保生物制品的安全性和质量,因此建立合适的宿主细胞残留DNA检测方法至关重要。《中国药典2020年版》通则3407中推荐了三种外源性DNA残留量测定方法,包括DNA探针杂交法、荧光染色法和定量PCR法。
表3 宿主细胞残留DNA检测方法
方法学 | DNA探针杂交法 | 荧光染色法 | 定量PCR法 |
检测原理 | 将特异性单链DNA探针标记后与供试品单链DNA杂交,并使用与标记物相应的显示系统显示杂交结果,与已知含量的阳性DNA对照比对后,根据显色的深浅判断供试品中外源性DNA残留量。 | 应用双链DNA荧光染料与双链DNA特异性结合形成复合物在波长480nm激发产生荧光型号,根据供试品的荧光强度,计算供试品中DNA的残留量。 | PCR反应过程中可通过荧光标记的特异性探针或荧光染料掺入而检测PCR产物量。在反应过程中释放的荧光强度达到阈值时,体系的PCR环数(Ct)与起始DNA板量的对数值呈线性关系。采用已知浓度的DNA标准品,构建标准曲线,对特定模板进行定量分析,测定供试品中的外源DNA残留量。 |
特异性 | 中 | 低 | 高 |
灵敏度 | 10fg/uL | 1pg/uL | 1fg/uL |
检测时长 | 5-6h | 0.5-1h | 1-1.5h |
检测范围 | 0.01-100pg/uL | 1.25-80pg/uL | 0.01-100pg/uL |
其中定量PCR法因其检测特异性高、灵敏度高、重现性好、通量高、耗时短等优点现已成为生物制品工艺研究和产品质量控制的检测方法。AG8亚国服务最终选择更准确、可靠、科学的荧光探针(TaqMan®)qPCR法作为细胞残留DNA检测的方法。推出了一系列宿主细胞残留核酸定量检测试剂盒,能够专一快速的对中控样品或原液成品中宿主细胞残留核酸进行准确定量,灵敏、准确和定量下限,能满足病毒疫苗生产、重组蛋白药物纯化、细胞治疗和疫苗研究中缓解PBMC细胞结团以及慢病毒的大规模纯化等工业客户的工艺研究和质控需求。
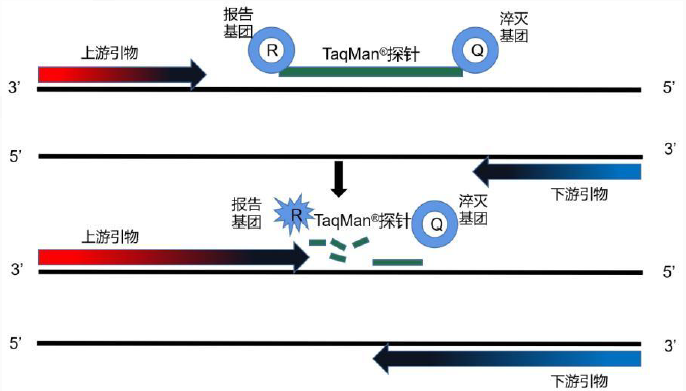
图 荧光探针(TaqMan®)qPCR法
宿主细胞残留DNA检测流程
宿主细胞残留DNA检测流程主要包含宿主细胞残留DNA提取(磁珠法)和宿主细胞残留DNA定量检测(荧光探针(TaqMan®)qPCR法)。

图 宿主细胞残留DNA检测流程
宿主细胞残留核酸提取
宿主细胞残留DNA(磁珠法)样本前处理试剂盒(abs60544)用于生物制品样本前处理,精准抽提各种生物制品中宿主细胞残留DNA。搭配宿主残留DNA/DNA片段检测试剂盒使用。
产品优势:
1)灵敏度高:灵敏度可达0.03pg/uL,回收率可达70-130%,符合国家药典标准;
2)通用性强:可手动提取、可配合全自动核酸提取仪自动化提取,满足高通量;
3)适用性强:适用于E.coli、HEK293、Vero、CHO等多种宿主DNA样本;
4)操作便捷:消化时间仅15min,配合核酸提取仪1h内完成整个提取过程。
产品信息:
样本核酸提取 | ||
货号 | 产品名称 | 规格 |
abs60544 | 宿主细胞残留DNA(磁珠法)样本前处理试剂盒 | 100T |
宿主细胞残留核酸/DNA片段检测
产品优势:
1)快速便捷:方便操作,1h出结果;
2)稳定性高:受环境影响较小,保质期内性能稳定;
3)精密度高:各浓度检测值CV<15%;
4)专一性强:考察生物制品生产中常用的DNA对检测试剂盒的干扰,干扰组应与对照组重合,未见干扰。
产品信息:
宿主细胞残留核酸检测 | ||
货号 | 产品名称 | 规格 |
abs60543 | 质粒DNA残留(qPCR)检测试剂盒 | 100T |
abs60545 | HEK293残留DNA(qPCR)检测试剂盒 | 100T |
abs60546 | 293T细胞残留DNA(qPCR)检测试剂盒 | 100T |
abs60547 | Human残留DNA(qPCR)检测试剂盒 | 100T |
abs60548 | Hela细胞残留DNA(qPCR)检测试剂盒 | 100T |
abs60549 | E1A残留DNA(qPCR)检测试剂盒 | 100T |
abs60550 | E1A&SV40LTA残留DNA(qPCR)检测试剂盒 | 100T |
abs60551 | E.coli残留DNA(qPCR)检测试剂盒 | 100T |
abs60552 | E.coli总RNA残留(qPCR)检测试剂盒 | 100T |
abs60553 | CHO残留DNA(qPCR)检测试剂盒 | 100T |
abs60554 | Vero残留 DNA(qPCR)检测试剂盒 | 100T |
abs60555 | 毕赤酵母残留DNA(qPCR)检测试剂盒 | 100T |
abs60556 | PG13残留DNA(qPCR)检测试剂盒 | 100T |
宿主细胞残留DNA片段分析 | ||
货号 | 产品名称 | 规格 |
abs60557 | HEK293残留DNA片段(qPCR)检测试剂盒 | 100T×4 |
abs60558 | 293T细胞残留DNA片段(qPCR)检测试剂盒 | 100T×4 |
abs60559 | Human残留DNA片段(qPCR)检测试剂盒 | 100T×4 |
abs60560 | Hela细胞残留DNA片段(qPCR)检测试剂盒 | 100T×4 |
abs60561 | Vero 残留 DNA 片段(qPCR)检测试剂盒 | 100T×4 |
参考文献
[1] State Administration for Market Regulation. Administrative measures for the batch release of biological products[S].2020-12-11
[2]《体内基因治疗产品药学研究与评价技术指导原则(试行)》,国家药品监督管理局药品审评中心,2022年5月
好消息!Absin文献奖励重磅升级!

Absin特色产品线:
WB相关:ECL发光液、预染marker、预制胶;IHC相关:二抗试剂盒、组化笔;IP/CoIP试剂盒;激动剂/抑制剂;血清、BSA、蛋白酶K、CTB、TTX、CEE;凋亡试剂盒;呼吸爆发试剂盒;ELISA试剂盒;重组蛋白;抗体: 二抗、标签抗体、对照抗体;定制服务(抗体/多肽/蛋白/标记/检测)...
电话
微信扫一扫
